- ۰۹۳۵۵۰۰۰۳۲۵
- info@ettpco.com
- شنبه تا پنجشنبه 9 صبح تا 6 بعد از ظهر
مقدمه
سنجش ایمونوسوربنت مرتبط با آنزیم که ELISA یا EIA نیز نامیده میشود، آزمایشی است که آنتیبادیهای موجود در خون شما را شناسایی و اندازهگیری میکند. از این آزمایش می توان برای تعیین اینکه آیا آنتی بادی های مرتبط با شرایط عفونی خاص دارید یا خیر، استفاده کرد. آنتی بادی ها پروتئین هایی هستند که بدن در پاسخ به مواد مضری به نام آنتی ژن تولید می کند.
تاریخچه
قبل از توسعه ELISA، تنها گزینه برای انجام یک ایمونواسی، رادیو ایمونواسی بود، تکنیکی که از آنتی ژن ها یا آنتی بادی های نشاندار شده رادیواکتیو استفاده می کرد. در رادیوایمونواسی، رادیواکتیویته سیگنالی را ارائه می دهد که نشان می دهد آنتی ژن یا آنتی بادی خاص در نمونه وجود دارد یا خیر. رادیوایمونواسی اولین بار در یک مقاله علمی توسط روزالین ساسمن یالو و سولومون برسون که در سال 1960 منتشر شد، توصیف شد.

Rosalyn Sussman Yalow and Solomon Aaron Berson
از آنجایی که رادیواکتیویته یک تهدید بالقوه برای سلامتی ایجاد می کند، جایگزین ایمن تری جستجو شد. یک جایگزین مناسب برای سنجش رادیو ایمونواکتیو، یک سیگنال غیر رادیواکتیو را به جای سیگنال رادیواکتیو جایگزین می کند. هنگامی که آنزیم ها (مانند پراکسیداز ترب کوهی) با سوبستراهای مناسب (مانند ABTS یا TMB) واکنش می دهند، تغییر رنگ رخ می دهد که به عنوان یک سیگنال استفاده می شود. با این حال، سیگنال باید با حضور آنتی بادی یا آنتی ژن مرتبط باشد، به همین دلیل است که آنزیم باید به یک آنتی بادی مناسب مرتبط شود. این فرآیند پیوند به طور مستقل توسط Stratis Avrameas و G. B. Pierce توسعه داده شد. از آنجایی که لازم است هر گونه آنتی بادی یا آنتی ژن غیر متصل را با شستشو ازبین ببرید، آنتی بادی یا آنتی ژن باید روی سطح ظرف ثابت شود. یعنی جاذب ایمنی باید تهیه شود. تکنیکی برای انجام این کار توسط واید و جرکر پورث در سال 1966 منتشر شد.
در سال 1971، پیتر پرلمان و اوا انگوال در دانشگاه استکهلم در سوئد، و آنتون شوورز و باوک ون ویمن در هلند به طور مستقل مقالاتی را منتشر کردند که این دانش را در روشهایی برای انجام EIA/ELISA ترکیب میکردند.
ELISA سنتی معمولا شامل گزارشگرها و بسترهای کروموژنیک است که نوعی تغییر رنگ قابل مشاهده برای نشان دادن وجود آنتی ژن یا آنالیت ایجاد می کند. تکنیکهای مشابه الایزا جدیدتر از گزارشگرهای PCR فلوروژنیک، الکتروشیمیتابیرسان و کمی مخالف برای ایجاد سیگنالهای قابل اندازهگیری استفاده میکنند. این گزارشگران جدید می توانند مزایای مختلفی از جمله حساسیت بالاتر و مالتی پلکسی داشته باشند.
از نظر فنی، سنجشهای جدیدتر از این نوع بهطور دقیق ELISA نیستند، زیرا “مرتبط با آنزیم” نیستند، اما در عوض به برخی از گزارشگرهای غیر آنزیمی مرتبط هستند. با این حال، با توجه به اینکه اصول کلی در این سنجش تا حد زیادی مشابه است، آنها اغلب در همان دسته ELISA گروه بندی می شوند.
در سال 2012، یک آزمایش الایزای فوق حساس و مبتنی بر آنزیم با استفاده از نانوذرات به عنوان گزارشگر کروموژنیک توانست سیگنال رنگی با چشم غیرمسلح را از تشخیص آتوگرامهای صرف از آنالیت بدهد. طبق سنجش کاتافی طیف رنگی آبی برای نتایج positive و طیف رنگی قرمز برای نتایج negative ظاهر میشود . توجه داشته باشید که این تشخیص تنها می تواند وجود یا عدم وجود آنالیت را تأیید کند، و غلظت واقعی را نمیتواند تایید کند .
الایزا چیست و چه کاربردی دارد ؟
سنجش ایمونوسوربنت متصل به آنزیم (ELISA) (/ɪˈlaɪzə/، /ˌiːˈlaɪzə/) یک سنجش بیوشیمی تحلیلی است که برای اولین بار توسط Eva Engvall و Peter Perlmann در سال 1971 توصیف شد.[1] این سنجش از نوع فاز جامد آنزیم ایمونواسی (EIA) برای تشخیص حضور لیگاند (معمولاً یک پروتئین) در نمونه مایع با استفاده از آنتی بادیهای ضد پروتئین مورد اندازهگیری استفاده میکند.
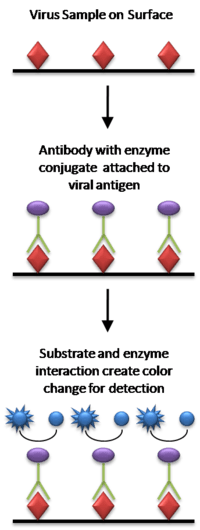
در ساده ترین شکل ELISA، آنتی ژن های نمونه مورد آزمایش به یک سطح متصل می شوند. سپس، یک آنتی بادی منطبق بر روی سطح اعمال می شود تا بتواند آنتی ژن را متصل کند. این آنتی بادی به یک آنزیم متصل می شود و سپس هر گونه آنتی بادی غیر متصل حذف می شود. در مرحله آخر ماده ای حاوی سوبسترای آنزیم اضافه می شود. اگر اتصال وجود داشته باشد، واکنش بعدی یک سیگنال قابل تشخیص تولید می کند که معمولاً تغییر رنگ است .
انجام ELISA شامل حداقل یک آنتی بادی با مختصات برای یک آنتی ژن خاص است. نمونه با مقدار ناشناخته آنتی ژن روی یک تکیه گاه جامد (معمولاً یک صفحه میکروتیتر پلی استایرن) به صورت غیر اختصاصی (از طریق جذب سطحی) یا به طور اختصاصی (از طریق جذب آنتی بادی دیگر مخصوص همان آنتی ژن، در یک “ساندویچ” بی حرکت می شود. “الیزا). پس از بی حرکت شدن آنتی ژن، آنتی بادی تشخیص اضافه می شود و با آنتی ژن کمپلکسی تشکیل می دهد. آنتی بادی تشخیص می تواند به صورت کووالانسی به یک آنزیم مرتبط باشد یا خود می تواند توسط یک آنتی بادی ثانویه که از طریق بیوکونژوگاسیون به آنزیم مرتبط است، شناسایی شود. بین هر مرحله، صفحه معمولاً با یک محلول شوینده ملایم شسته می شود تا پروتئین ها یا آنتی بادی هایی که به طور غیر اختصاصی متصل هستند حذف شود. پس از مرحله نهایی شستشو، پلیت با افزودن یک بستر آنزیمی برای تولید یک سیگنال قابل مشاهده، که مقدار آنتی ژن در نمونه را نشان می دهد، توسعه می یابد.
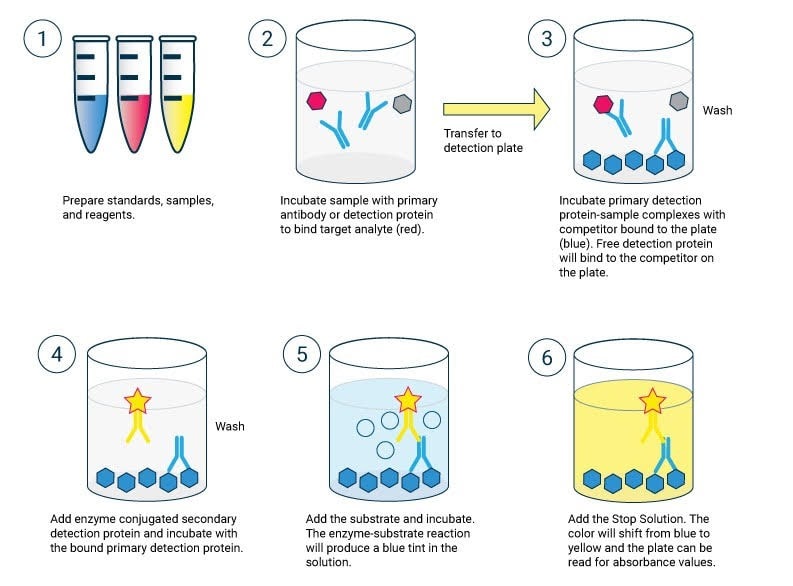
شایان ذکر است، ELISA میتواند اشکال دیگری از سنجشهای اتصال لیگاند را به جای سنجشهای کاملاً “ایمونو” انجام دهد، اگرچه نام “ایمونو” اصلی به دلیل استفاده رایج و سابقه توسعه این روش بود. این تکنیک اساساً به هر معرف اتصال دهنده ای نیاز دارد که بتواند روی فاز جامد به همراه یک معرف تشخیص که به طور خاص متصل شود و از یک آنزیم برای تولید سیگنالی استفاده کند که می تواند به درستی کمیت شود، بی حرکت شود. در بین شستشوها، فقط لیگاند و همتایان اتصال خاص آن به طور خاص توسط فعل و انفعالات آنتی ژن-آنتی بادی به فاز جامد متصل یا “ایمونوسورب شده” می مانند، در حالی که اجزای غیر اختصاصی یا غیر متصل شسته می شوند. بر خلاف سایر فرمتهای سنجش آزمایشگاهی مرطوب اسپکتروفتومتری که در آنها میتوان از همان چاه واکنش (مثلاً یک کووت) پس از شستشو استفاده مجدد کرد، صفحات الایزا محصولات واکنش را روی فاز جامد که بخشی از صفحه است، ایمونوسورب میکنند و بنابراین به راحتی قابل استفاده مجدد نیستند. .
کاربرد ها
الایزا را می توان برای تعیین غلظت آنتی بادی سرم در یک آزمایش ویروسی (مانند آزمایش HIV تست ویروس نیل غربی) اعمال کرد. کاربردهای الایزا در تست حاملگی خانگی و در صنایع غذایی هنگام تشخیص آلرژن های غذایی بالقوه مانند شیر، بادام زمینی، گردو، بادام و تخم مرغ نیز یافت شده است. ELISA همچنین می تواند در سم شناسی به عنوان یک غربالگری سریع برای کلاس های خاصی از داروها استفاده شود. ELISA به طور گسترده در زمینه های مختلفی مانند ایمونولوژی، داروسازی بیولوژیکی، صنایع تشخیصی و غیره استفاده می شود.
قاعده کلی
به عنوان یک سنجش بیوشیمی تحلیلی و یک تکنیک “آزمایشگاه مرطوب”، ELISA شامل تشخیص یک آنالیت (یعنی ماده خاصی که حضور آن از نظر کمی یا کیفی در حال تجزیه و تحلیل کمی یا کیفی است) در یک نمونه مایع با روشی که همچنان به استفاده از معرفهای مایع در طول آنالیز ادامه میدهد. (یعنی توالی کنترل شده ای از واکنش های بیوشیمیایی که سیگنالی تولید می کند که به راحتی می تواند کمیت شود و به عنوان معیاری از مقدار آنالیت در نمونه تفسیر شود) که مایع می ماند و در داخل یک محفظه واکنش باقی می ماند یا به خوبی لازم است تا واکنش دهنده ها را در خود نگه دارد. این برخلاف تکنیک های “آزمایشگاه خشک” است که از نوارهای خشک استفاده می کنند. حتی اگر نمونه مایع باشد (به عنوان مثال، یک قطره کوچک اندازه گیری شده)، مرحله تشخیص نهایی در تجزیه و تحلیل “خشک” شامل خواندن یک نوار خشک شده با روش هایی مانند بازتاب سنجی است و برای جلوگیری از سرریز یا اختلاط بین نمونه ها به محفظه مهار واکنش نیاز ندارد.
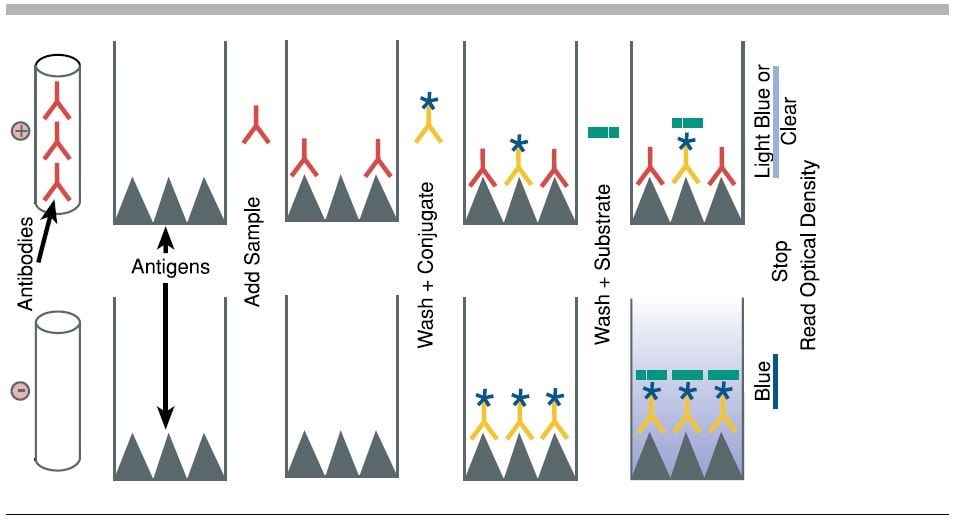
به عنوان یک روش هتروژن، ELISA برخی از اجزای مخلوط واکنش تحلیلی را با جذب اجزای خاص روی یک فاز جامد که از نظر فیزیکی بی حرکت است جدا می کند. در الایزا، یک نمونه مایع به یک فاز جامد ثابت با خواص اتصال ویژه اضافه میشود و پس از آن چندین معرف مایع اضافه میشوند، انکوبه میشوند و شسته میشوند و به دنبال آن مقداری تغییر نوری (مثلاً ایجاد رنگ توسط محصول یک آنزیمی) ایجاد میشود. واکنش) در مایع نهایی در چاهی که مقدار آنالیت از آن اندازه گیری می شود. “خواندن” کمی معمولاً بر اساس تشخیص شدت نور عبوری توسط اسپکتروفتومتری است که شامل کمی سازی انتقال برخی از طول موج های خاص نور از طریق مایع (و همچنین کف شفاف چاه در قالب صفحه چند چاهی) است. حساسیت تشخیص بستگی به تقویت سیگنال در طول واکنش های تحلیلی دارد. از آنجایی که واکنشهای آنزیمی فرآیندهای تقویتی بسیار شناخته شدهای هستند، سیگنال توسط آنزیمهایی تولید میشود که به معرفهای تشخیص در نسبتهای ثابتی متصل میشوند تا امکان کمیسازی دقیق را فراهم کنند، و بنابراین نام آنزیم مرتبط است.
آنالیت را لیگاند نیز می نامند زیرا به طور خاص به یک معرف تشخیص متصل می شود یا به آن متصل می شود، بنابراین ELISA در دسته بزرگتر سنجش های اتصال لیگاند قرار می گیرد. معرف اتصال ویژه لیگاند “بی حرکت” می شود، یعنی معمولاً روی کف شفاف و گاهی اوقات دیواره جانبی چاه پوشانده و خشک می شود (در اینجا “فاز جامد”/”زیر لایه جامد” ثابت برخلاف ریزذره جامد. ( دانههایی که قابل شستشو هستند)، که معمولاً بهعنوان یک صفحه چند چاهی معروف به «صفحه الایزا» ساخته میشود. به طور معمول، مانند سایر اشکال ایمونواسی، از ویژگی واکنش نوع آنتی ژن-آنتی بادی استفاده می شود، زیرا به راحتی می توان یک آنتی بادی را به طور خاص علیه یک آنتی ژن به صورت فله ای به عنوان یک معرف ایجاد کرد. از طرف دیگر، اگر آنالیت خود یک آنتی بادی باشد، آنتی ژن هدف آن می تواند به عنوان معرف اتصال استفاده شود.
انواع
الایزا مستقیم
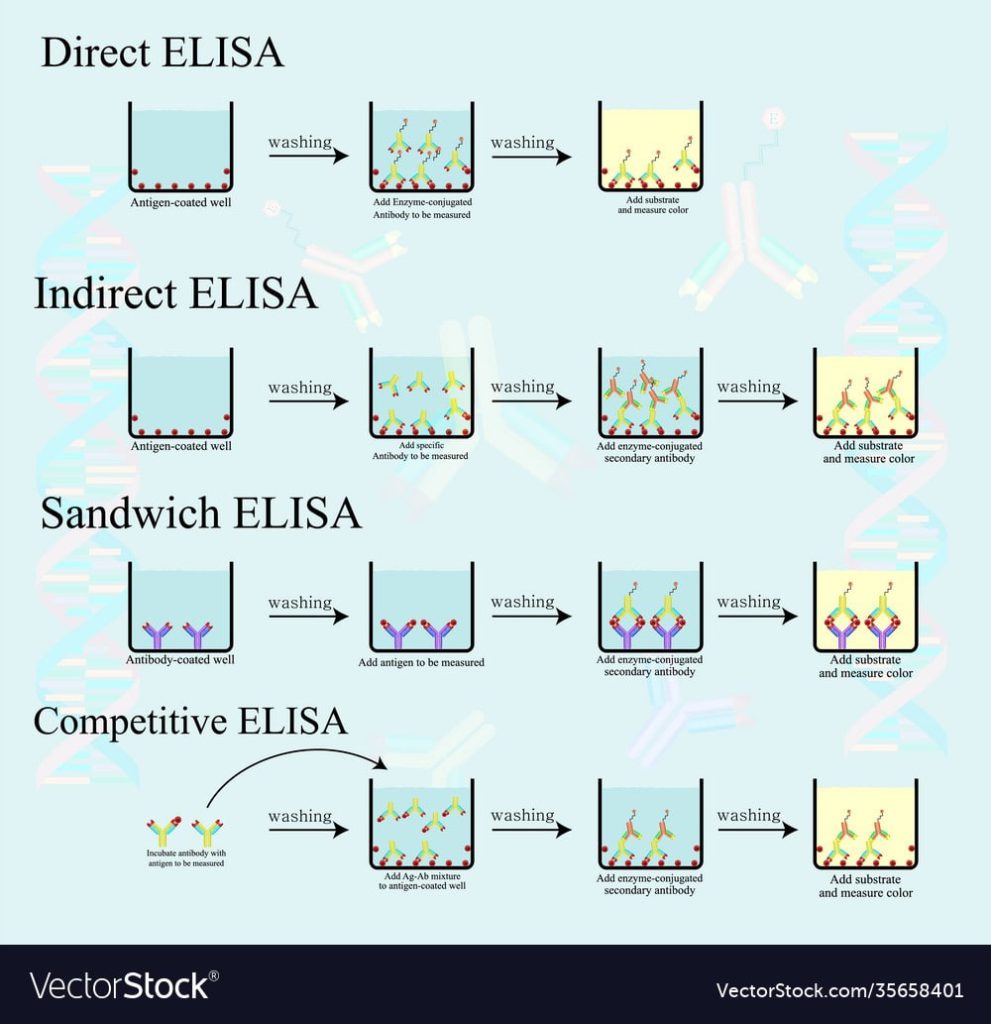
ELISA مستقیم ساده ترین فرمت است که به آنتی ژن و آنتی بادی کونژوگه با آنزیم مخصوص آنتی ژن نیاز دارد. این فصل مراحل فردی برای تشخیص یک آنتی ژن متصل به صفحه را با استفاده از یک آنتی بادی کونژوگه با پراکسیداز ترب کوهی (HRP) و سوبسترای نورتابی شیمیایی تقویت شده مبتنی بر لومینول (ECL) توصیف می کند.
مراحل ELISA مستقیم از مکانیسم زیر پیروی می کند:
یک محلول بافر از آنتی ژنی که باید برای آن آزمایش شود به هر چاهک (معمولاً صفحات 96 چاهی) یک صفحه میکروتیتر اضافه می شود، جایی که به آن زمان داده می شود تا از طریق فعل و انفعالات بار به پلاستیک بچسبد.
محلولی از پروتئین غیر واکنشدهنده، مانند آلبومین سرم گاوی یا کازئین، به هر چاهک اضافه میشود تا هر سطح پلاستیکی در چاه را که توسط آنتیژن پوشش داده نشده است، بپوشاند.
آنتی بادی اولیه با یک آنزیم متصل (کونژوگه) اضافه می شود که به طور خاص به آنتی ژن آزمایشی پوشش دهنده چاه متصل می شود.
سپس یک سوبسترا برای این آنزیم اضافه می شود. اغلب، این سوبسترا با واکنش با آنزیم تغییر رنگ می دهد.
هر چه غلظت آنتی بادی اولیه موجود در سرم بیشتر باشد، تغییر رنگ قوی تر است. اغلب، یک طیف سنج برای دادن مقادیر کمی برای قدرت رنگ استفاده می شود.
آنزیم به عنوان یک تقویت کننده عمل می کند.
حتی اگر تنها تعداد کمی از آنتی بادی های مرتبط با آنزیم متصل باقی بمانند، مولکول های آنزیم مولکول های سیگنال زیادی تولید می کنند. در محدودیتهای عقل سلیم، آنزیم میتواند به طور نامحدود به تولید رنگ ادامه دهد، اما هر چه آنتیبادی بیشتر باشد، رنگ سریعتر ایجاد میشود. یک عیب عمده ELISA مستقیم این است که روش بی حرکتی آنتی ژن خاص نیست. هنگامی که سرم به عنوان منبع آنتی ژن آزمایشی استفاده می شود، تمام پروتئین های نمونه ممکن است به خوبی به صفحه میکروتیتر بچسبند، بنابراین غلظت های کوچک آنالیت در سرم باید هنگام اتصال به سطح چاه با سایر پروتئین های سرم رقابت کند. ساندویچ یا ELISA غیرمستقیم با استفاده از یک آنتی بادی “گرفتن” مخصوص آنتی ژن آزمایشی، راه حلی برای این مشکل ارائه می دهد تا آن را از مخلوط مولکولی سرم خارج کند
ELISA ممکن است در قالب کیفی یا کمی اجرا شود. نتایج کیفی یک نتیجه ساده مثبت یا منفی (بله یا خیر) برای یک نمونه ارائه می دهد. برش بین مثبت و منفی توسط تحلیلگر تعیین می شود و ممکن است آماری باشد. دو یا سه برابر انحراف معیار (خطای ذاتی در آزمایش) اغلب برای تشخیص نمونه های مثبت از منفی استفاده می شود. در الایزای کمی، چگالی نوری (OD) نمونه با یک منحنی استاندارد مقایسه میشود که معمولاً رقتسازی سریالی محلول با غلظت مشخص مولکول هدف است. به عنوان مثال، اگر یک نمونه آزمایشی OD 1.0 را برمی گرداند، نقطه روی منحنی استاندارد که OD = 1.0 را می دهد باید همان غلظت آنالیت نمونه باشد.
کاربرد و معنای نامهای “الیزای غیرمستقیم” و “الیزای مستقیم” در ادبیات و در وبسایتها بسته به زمینه آزمایش متفاوت است. هنگامی که وجود یک آنتی ژن تجزیه و تحلیل می شود، نام “الایزا مستقیم” به یک ELISA اشاره دارد که در آن فقط یک آنتی بادی اولیه نشاندار استفاده می شود، و اصطلاح “الایزای غیرمستقیم” به یک ELISA اشاره دارد که در آن آنتی ژن توسط آنتی بادی اولیه متصل می شود. که سپس توسط یک آنتی بادی ثانویه نشاندار شناسایی می شود. در مورد دوم، یک الایزای ساندویچی به وضوح از یک الایزای غیرمستقیم متمایز است. هنگامی که آنتی بادی “اولیه” مورد توجه است، به عنوان مثال. در مورد آنالیزهای ایمن سازی، این آنتی بادی مستقیماً توسط آنتی بادی ثانویه شناسایی می شود و اصطلاح “الایزای غیرمستقیم” برای محیطی با دو آنتی بادی به کار می رود.
الایزای ساندویچ
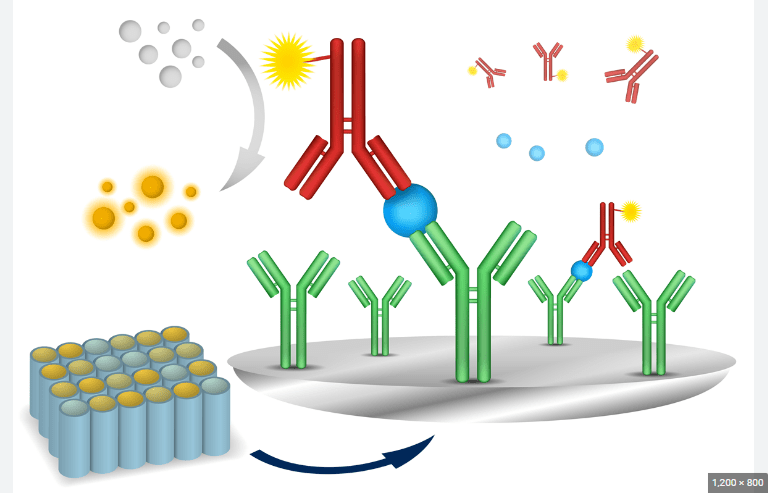
برای تشخیص آنتی ژن نمونه از یک ELISA “ساندویچ” استفاده می شود. مراحل عبارتند از:
تصویر سمت راست شامل استفاده از یک آنتی بادی ثانویه کونژوگه به یک آنزیم است، اگرچه، از نظر فنی، اگر آنتی بادی اولیه به یک آنزیم (که ELISA مستقیم است) کونژوگه شده باشد، این کار ضروری نیست. با این حال، استفاده از کونژوگه آنتی بادی ثانویه از فرآیند گران قیمت ایجاد آنتی بادی های مرتبط با آنزیم برای هر آنتی ژنی که ممکن است بخواهد شناسایی شود، جلوگیری می کند. با استفاده از یک آنتی بادی مرتبط با آنزیم که به ناحیه Fc سایر آنتی بادی ها متصل می شود، می توان از همین آنتی بادی مرتبط با آنزیم در موقعیت های مختلف استفاده کرد. بدون اولین لایه آنتی بادی “گرفتن”، هر پروتئینی در نمونه (از جمله پروتئین های سرم) ممکن است به طور رقابتی به سطح صفحه جذب شود و مقدار آنتی ژن تثبیت شده را کاهش دهد. استفاده از آنتی بادی اختصاصی خالص شده برای اتصال آنتی ژن به پلاستیک، نیاز به خالص سازی آنتی ژن از مخلوط های پیچیده قبل از اندازه گیری را برطرف می کند، سنجش را ساده می کند و ویژگی و حساسیت سنجش را افزایش می دهد. بنابراین، ساندویچ الایزای مورد استفاده برای تحقیقات اغلب نیاز به اعتبارسنجی دارد تا خطر نتایج مثبت کاذب را کاهش دهد.
الایزای رقابتی
سومین کاربرد الایزا از طریق اتصال رقابتی است. مراحل انجام این الایزا تا حدودی با دو مثال اول متفاوت است:
آنتی بادی بدون برچسب در حضور آنتی ژن آن (نمونه) انکوبه می شود.
سپس این کمپلکسهای آنتیبادی/آنتیژن متصل به یک چاه پوشیده شده با آنتیژن اضافه میشوند.
صفحه شسته می شود، بنابراین آنتی بادی های غیرمجاز حذف می شوند. (هر چه آنتی ژن در نمونه بیشتر باشد، کمپلکس های Ag-Ab بیشتری تشکیل می شود و بنابراین آنتی بادی های غیر متصل کمتری برای اتصال به آنتی ژن در چاه وجود دارد، بنابراین “رقابت”)
آنتی بادی ثانویه، مخصوص آنتی بادی اولیه، اضافه می شود. این آنتی بادی دوم با آنزیم جفت می شود.
یک سوبسترا اضافه می شود و آنزیم های باقی مانده یک سیگنال کروموژنیک یا فلورسنت ایجاد می کنند.
واکنش متوقف می شود تا از اشباع نهایی سیگنال جلوگیری شود.
برخی از کیت های رقابتی ELISA شامل آنتی ژن مرتبط با آنزیم به جای آنتی بادی مرتبط با آنزیم است. آنتی ژن نشاندار شده برای محل های اتصال آنتی بادی اولیه با آنتی ژن نمونه (بدون برچسب) رقابت می کند. هر چه آنتی ژن در نمونه کمتر باشد، آنتی ژن نشاندار بیشتری در چاه باقی می ماند و سیگنال قوی تر می شود.
معمولاً آنتی ژن ابتدا در چاه قرار نمی گیرد.
برای تشخیص آنتی بادی های HIV، چاه های صفحه میکروتیتر با آنتی ژن HIV پوشانده می شود. دو آنتی بادی اختصاصی استفاده می شود، یکی با آنزیم کونژوگه شده و دیگری در سرم وجود دارد (اگر سرم برای آنتی بادی مثبت باشد). رقابت تجمعی بین دو آنتی بادی برای آنتی ژن یکسان رخ می دهد و باعث می شود سیگنال قوی تری دیده شود. سرم های مورد آزمایش به این چاهک ها اضافه می شوند و در دمای 37 درجه سانتی گراد انکوبه می شوند و سپس شسته می شوند. اگر آنتی بادی وجود داشته باشد، واکنش آنتی ژن-آنتی بادی رخ می دهد. هیچ آنتی ژنی برای آنتی بادی های خاص HIV نشاندار شده با آنزیم باقی نمانده است. این آنتی بادی ها پس از اضافه شدن آزاد می مانند و در حین شستشو شسته می شوند. سوبسترا اضافه می شود، اما هیچ آنزیمی وجود ندارد که روی آن اثر بگذارد، بنابراین نتیجه مثبت تغییر رنگی را نشان نمی دهد.
الایزای معکوس (الایزای غیر مستقیم)
یک سنجش ایمونوسوربنت متصل به آنزیم (ELISA) معکوس (گرفتن آنتی بادی) برای تشخیص آنتی بادی های ضد اسپرم توسعه یافته است. این روش تشخیص ایمونوگلوبولین (Ig)M، IgG، IgA، یا IgM، IgG، و IgA-آنتی بادی های ضد اسپرم در سرم، مخاط دهانه رحم و نمونه های پلاسمای منی را امکان پذیر می کند. الایزای معکوس نسبت به الایزای معمولی در تشخیص آنتیبادیهای ضد اسپرم انسانی از ایزوتیپهای مختلف اختصاصیتر و حساستر است. با استفاده از این روش، تفاوت آماری معنیداری در سطوح آنتیبادیها بین افراد نابارور و بارور در سرمها و ترشحات دستگاه تناسلی نشان داده شد. مطالعات روی 143 زوج نابارور نشان داد که وجود آنتی بادی در سرم ها لزوماً در ترشح دستگاه تناسلی فرد منعکس نمی شود و بالعکس. این داده ها بر اهمیت تشخیص آنتی بادی های ضد اسپرم در سرم و همچنین در ترشحات دستگاه تناسلی برای ارزیابی صحیح ایمنی اسپرم تاکید می کنند.
چهارمین آزمایش الایزا از چاه های سنتی استفاده نمی کند. این آزمایش آنتی ژن ها را در مایع آزمایش معلق می گذارد.
آنتی بادی بدون برچسب در حضور آنتی ژن آن انکوبه می شود (نمونه)
یک دوره کمون کافی برای اتصال آنتی بادی ها به آنتی ژن ها فراهم شده است.
سپس نمونه از ظرف Scavenger عبور داده می شود. این می تواند یک لوله آزمایش یا یک جریان از طریق کانال طراحی شده باشد. سطح ظرف یا کانال Scavenger دارای “آنتی ژن Scavenger” است. اینها می توانند یکسان یا به اندازه کافی شبیه آنتی ژن های اولیه باشند که آنتی بادی های آزاد به آن متصل می شوند.
ظرف Scavenger باید سطح کافی و زمان کافی داشته باشد تا آنتی ژن های Scavenger به تمام آنتی بادی های اضافی وارد شده به نمونه متصل شوند.
نمونه ای که اکنون حاوی آنتی بادی های برچسب گذاری شده و متصل شده است، از طریق یک آشکارساز عبور داده می شود. این دستگاه می تواند فلوسیتومتر یا دستگاه دیگری باشد که تگ ها را روشن می کند و پاسخ را ثبت می کند.
این آزمایش به چندین آنتی ژن اجازه می دهد تا به طور همزمان برچسب گذاری و شمارش شوند. این اجازه می دهد تا گونه های خاصی از باکتری ها با دو (یا چند) برچسب رنگی مختلف شناسایی شوند. اگر هر دو تگ روی یک سلول وجود داشته باشد، آن سلول همان سویه خاص است. اگر فقط یکی حضور داشته باشد، نیست.
این آزمایش به طور کلی یک آزمایش در یک زمان انجام می شود و با پلیت میکروتیتر قابل انجام نیست. تجهیزات مورد نیاز معمولاً پیچیدگی کمتری دارند و می توان از آنها در زمینه استفاده کرد.
مزایا و معایب انواع روش های الایزا
مزایا معایب
الایزا مستقیم
| پروتکل کوتاه: باعث صرفه جویی در زمان و معرف ها می شود. عدم واکنش متقابل از آنتی بادی ثانویه. | پس زمینه بالقوه بالا: تمام پروتئین های نمونه به سطح متصل می شوند. بدون تقویت سیگنال انعطاف پذیری کم: آنتی بادی اولیه باید کونژوگه شود. |
الایزای غیر مستقیم
| تقویت سیگنال: چندین آنتی بادی ثانویه به آنتی بادی اولیه متصل می شوند. انعطاف پذیری بالا: همان آنتی بادی ثانویه ممکن است برای چندین آنتی بادی اولیه استفاده شود | پروتکل طولانی اگر با الایزا مستقیم مقایسه شود. واکنش متقابل بالقوه از آنتی بادی ثانویه |
الایزا ساندویچ
| ویژگی بالا: شامل دو آنتی بادی است که اپی توپ های مختلف را روی یک آنتی ژن یکسان تشخیص می دهند. مناسب برای نمونه های پیچیده انعطاف و حساسیت بالا: می توان از هر دو روش مستقیم و غیر مستقیم استفاده کرد. | یافتن دو آنتی بادی علیه یک هدف که اپی توپ های مختلف را تشخیص می دهند و به خوبی با هم کار می کنند، گاهی اوقات می تواند چالش برانگیز باشد. |
الایزا رقابتی
| بستگی به ELISA پایه انتخاب شده دارد. برای آنتی ژن های کوچک مناسب است | بستگی به ELISA پایه انتخاب شده دارد |
